Molecular Imaging
Forschung und Techniken/ Offene Stellen
M. Lauterbach | Molekulare Bildgebung
Unser Ziel ist es, das Zusammenspiel von Ultrastruktur und Funktion in Neuronen und Gliazellen zu verstehen. Dazu, wenden wir moderne optische und elektrophysiologische Techniken an und entwickeln sie weiter, insbesondere auf dem Gebiet der Hochauflösungsmikroskopie. Mit einem interdisziplinären Ansatz zwischen Physik und Neurowissenschaften überbrücken wir die Lücke zwischen der Entwicklung neuer Mikroskopietechniken und deren direkter Anwendung.
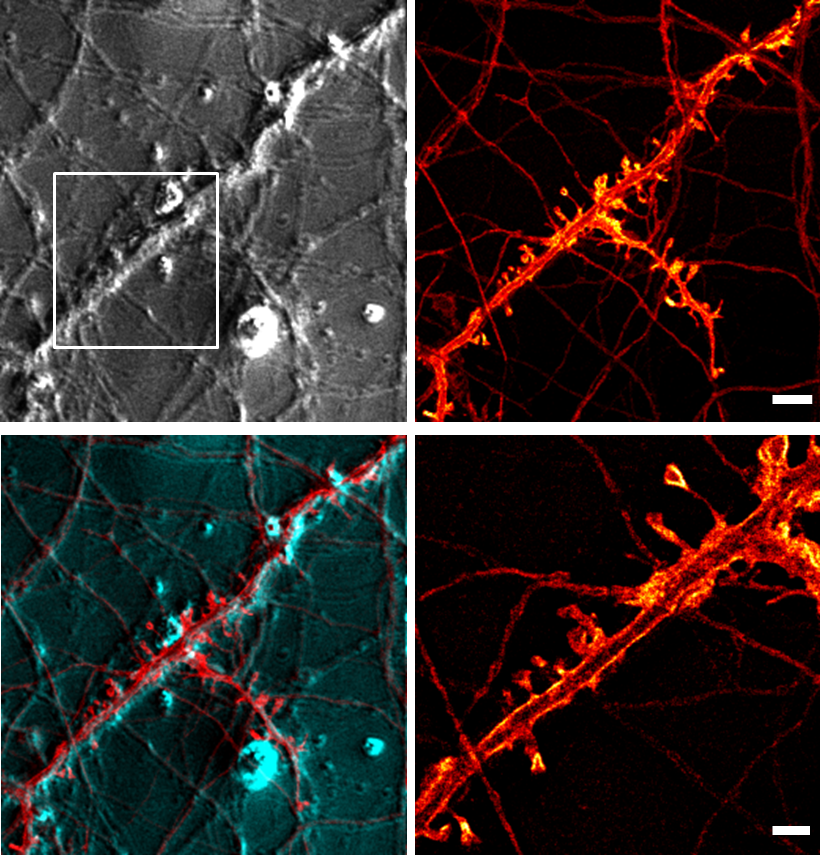
Bei den optischen Techniken konzentrieren wir uns auf die STED-Mikroskopie (Stimulated Emission Depletion Microscopy), eine optische Hochauflösungstechnik zur Abbildung von lebendem und fixiertem Gewebe mit einer Auflösung jenseits der Beugungsgrenze. Die STED-Mikroskopie gibt uns Informationen über die Struktur und strukturelle Veränderungen. Diese Informationen kombinieren wir dann mit funktionellen Aufnahmen unter Verwendung von Kalziumbildgebung und elektrophysiologischen Techniken. Außerdem entwickeln wir neue Bildgebungsverfahren und bauen ein Mikroendoskopiesystem für die funktionelle Bildgebung zellulärer Signale.
Darüber hinaus ist das Labor daran interessiert, Struktur und Funktion in nicht-traditionellen Modellorganismen zu erforschen, um evolutionär konservierte Mechanismen zu identifizieren und experimentelle Vorteile zu erzielen. Daher ist unser Hauptmodellorganismus die Schildkröte, aber wir arbeiten auch mit Mäusen.
Die offenen Stellen finden Sie unten auf dieser Seite.
 |
STED-Mikroskopie
Die STED-Mikroskopie ist eine optische, sogenannte "Superauflösungs"/”Hochauflösungs”-Mikroskopietechnik, die eine höhere Auflösung als herkömmliche optische Mikroskopie bietet. Diese höhere Auflösung führt zu einer höheren nutzbaren Vergrößerung. Ihre Erfindung wurde 2014 mit dem Nobelpreis für Chemie ausgezeichnet.
Kalzium-Bildgebung
Calcium ist ein wichtiges Signalmolekül in Neuronen und Gliazellen. Die Aktivität der Zellen ist mit Veränderungen der intrazellulären Kalziumkonzentration korreliert. Indikatorfarbstoffe ermöglichen es, diese Änderungen der Calcium-Konzentration in Änderungen der Fluoreszenz umzuwandeln. Die Aktivität der Zellen kann so durch Aufnahme der Fluoreszenzintensität beobachtet werden. Auf diese Weise können viele Zellen im Netzwerk gleichzeitig untersucht warden.
Mikroendoskopie
Um in-vivo-Bildgebung funktioneller Signale zu ermöglichen, entwickeln wir ein dünnes Mikroendoskopiesystem. Dieses basiert auf einem Mehrkern-Faserbündel und zielt darauf ab, funktionelle Signale mit Einzelzellauflösung aufzunehmen. Dieses System ist kleiner als bestehende Ansätze ist und verfügt gleichzeitig über Mehrkanalfunktionalität. Das Mikroendoskop ermöglicht es uns, die Reaktionen einzelner Zellen während Interorgankommunikation und in verschiedenen Krankheitsmodellen aufzuzeichnen.
Elektrophysiologie
Mikroelektroden ermöglichen die Messung des Membranpotentials von Zellen. Ihre Aktivität und die Erzeugung von Aktionspotentialen können so mit hoher zeitlicher Auflösung verfolgt werden.
Schildkröten
Die evolutionäre Position von Reptilien im Vergleich zu Säugetieren macht das Reptilienhirn zu einem interessanten Modellsystem, um die strukturelle und funktionelle Evolution der neuronalen Schaltkreise von Wirbeltieren zu untersuchen. Schildkröten haben einen ungefalteten Kortex, der in nur drei Zellschichten unterteilt ist - im Gegensatz zum Säugetier-Kortex, der sechs Schichten hat. Damit ähnelt der Schildkrötenkortex den Teilen des Säugetiergehirns (Hippocampus, Riechkolben), die als evolutionär alt gelten. Hier können wahrscheinlich allgemeine – evolutionär alte – Prinzipien der neuronalen Signalverarbeitung entdeckt und verstanden werden.
Transgene Mäuse
Um die Morphologie und Funktion von Nervenzellen in bestimmten Hirnarealen zu identifizieren, bedarf es einer spezifischen Visualisierung. Mit Hilfe verschiedener transgener Mäuse von unseren Kooperationspartnern in der Abteilung Molekularphysiologie induzieren wir die Expression fluoreszenter Proteine in spezifischen Zelltypen und Hirnarealen.
Offene Stellen
Wir bieten zum nächstmöglichen Zeitpunkt für die Fachrichtung Molekular Bildgebung folgende Stelle an:
|
|
Sekretariats-/Verwaltungskraft(m/w/d) |
Das ist Ihr Arbeitsbereich:
Arbeitsgruppe Molekulare Bildgebung am Centrum für Integrative Physiologie und Molekulare Medizin (CIPMM) der Universität des Saarlandes in Homburg. Wir sind ein interdisziplinäres und internationales Team, das verschiedene Techniken, u.a. die Nobelpreisgekrönte STED-Mikroskopie, für neurowissenschaftliche Forschung einsetzt. Wir arbeiten eng mit anderen Arbeitsgruppen des CIPMM zusammen. Im Sekretariat werden Sie die große Stütze der Abteilung, die alle administrativen Belange selbständig im Blick behält. Sie unterstützen nicht nur den Chef, sondern sind wichtige*r Ansprechpartner*in für alle Mitarbeitenden und für Studierende. Weitere Details im pdf.
Kennziffer N2140, Vergütung nach TV-L, Entgeltgruppe E6, Beschäftigungsdauer: befristet für 2 Jahre mit der Option auf unbefristete Verlängerung, Beschäftigungsumfang: 50 % der tariflichen Arbeitszeit.
Wir freuen uns auf Ihre aussagekräftige Online-Bewerbung (mit Anschreiben, Lebenslauf und Zeugnissen in einer PDF-Datei) bis zum 07.09.2025 an
Bei Fragen können Sie sich gerne an uns wenden. Ihre Ansprechperson:
Herr Prof. Dr. Marcel Lauterbach
CIPMM, Gebäude 48, 66421 Homburg
Tel.: 06841-16-16410
Wir bieten motivierten Studenten der Biologie, Humanbiologie, Medizin, Veterinärmedizin, Physik, oder verwandter Fächer an, mit modernen Techniken und ungewöhnlichen Modellorganismen im Rahmen ihrer Bachelor-, Master-, oder Doktorarbeit zu arbeiten.
Molecular Imaging

Prof. Dr.
Marcel Lauterbach
| +49 6841/16-16410 |
 |
Curriculum Vitae |
Saarland University
Medical Faculty
Prof. Dr. Marcel Lauterbach
CIPMM | Building 48
D-66421 Homburg (Saar)


